欲輸入【皮膚科用雷射儀】之查驗登記申請流程
*廠商須先取得藥商登記,向所在地直轄市或縣(市)政府衛生局申請核准登記,國產(製造)業者需取得「製造業藥商許可執照」、進口(輸入)業者須取得「販賣業藥商許可執照」。
1. 判斷是否屬列管之醫療器材
• 已確認皮膚科用雷射儀為列管之醫療器材, 須向衛生署辦理查驗登記.
2.判別醫療器材分類分級
• 查詢得知欲輸入之產品為第二等級之醫療器材, 分類分級代碼為:
• I. 4810 一般外科、整形外科及皮膚科用雷射儀
(Laser surgical instrument for use in general and plastic surgery and in dermatology)
3.辦理查驗登記
• 依據法規檢附相關資料至行政院衛生署食品藥物管理局辦理查驗登記申請.
4.查驗登記需檢附資料
• 審查費10,000元整,領證費1,500元整。
所需文件:
1.第二、三等級申請醫療器材查驗登記案件送審表
2.第二、三等級申請醫療器材查驗登記案件資料表
3.醫療器材製造輸入查驗登記申請書(正、副本)各1份
4.相關行政文件、技術文件及測試報告。
 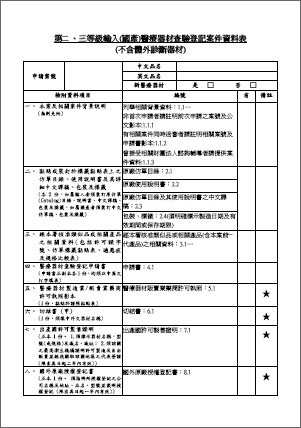
查驗登記送審表 & 案件資料表
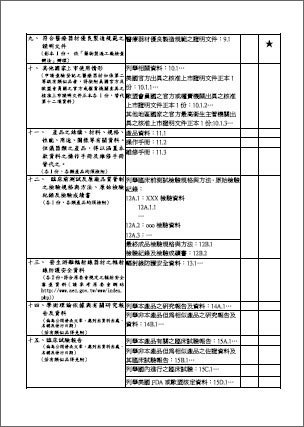 
查驗登記申請書

4-1 行政資料
• 查驗登記申請書
• 仿單標籤黏貼表
• 證照黏貼表
• 切結書(甲)
• 出產國許可製售證明
• 原廠授權登記書
• 符合醫療器材優良製造規範之證明文件
• 經衛生署核准之類似品相關資料
 
仿單標籤黏貼表 & 切結書(甲)
 
中文仿單
出產國許可製售證明
• 出產國許可製售證明正本。
• 為該國之最高衛生主管機關出具之證明文件,有效期限為兩年。
• 載明器材名稱,型號(或規格)及製造廠名、廠址,許可製造及自由販賣。
• 須經我國駐該國地區外交商務辦事處之簽證,如以英文出具,或同時檢附中文或英文譯本,且譯本亦須簽證。
• 限出具日起二年內有效。
• 若屬委託製造,而未在製造廠所在國家上市者,可以委託者所在國出具自由販賣證明及受託製造廠所在國出具製造證明代替。
• 第二等級之產品,可以製造國出具製造證明及美國或歐盟會員國最高衛生單位出具之核准販售證明(須載明製造廠名稱及地址)代替。
 
製售證明 & 簽證
原廠授權登記書
• 國外原廠授權登記書。
• 須為正本
若正本已先行檢附於本署其他申請案件,可以影本代替,但必須提供正本所在案號及品名,經承辦人確認正本於衛生署即可。
• 須載明以下資料:
1.和製售證明一致之製造廠名稱及地址。
2.授權登記之公司名稱及地址、品名、型號或所有產品。
• 須載明授權登記 (authorized to register)
• 限出具日起一年內有效。

4-2 技術性資料
1.臨床前測試及原廠品質管制之檢驗規格與方法、原始檢驗紀錄及檢驗成績書(範例)
2.產品之結構、材料、規格、性能、用途、圖 樣等有關資料
3.安全性試驗報告
品質管製紀錄
• 品質管製記錄第一部分應對如何進行產品功能試驗進行描述,也就是提供試驗程序、標準,或簡述實驗方法。第二部分為功能性測試,可參照國際標準。第三部分為原廠品質管制,包含最終成品出廠測試、製程中品質管制等資料,隨不同產品及原廠而有不同報告格式及內容但所有檢驗資料內容應詳細記載製造廠名、廠址、品名、型號,並有檢驗人員簽名,並應有該產品之任一批次滅菌放行報告。
產品結構有關技術資料
• 各產品須檢附兩份本資料。
• 應包含產品結構圖樣、材料、規格、性能、用途等。
1.所有產品皆須檢附產品之圖樣(方塊圖,含結構說明)、各部份組成材料(與人體接觸者),圖樣上所示結構須能對照至其材質說明
2.使用方法及用途說明、產品性能等。儀器類可以含有前述技術資料之操作手冊及維修手冊代替之,但每個型號產品均須檢附。
3.耗材類如屬同類型(相同結構及組成材料)產品,僅尺寸不同者,檢附代表型號即可與人體接觸部分須明列產品組成、材質之對照表,並須與所附之結構圖相對應。
4.規格須說明清楚
安全性測試
•一般安全性測試內容包括:
1. 儀器類:
儀器類的安全性測試,包括電性安全(如IEC 60601-1) 、電磁相容性(如IEC 60601-1-2) 、輻射安全防護(如IEC 60601-1-3) 、醫療器材軟體確效(如IEC 62304)等。
2. 生醫材料:
生醫材料的安全性測試,包括生物相容性(如ISO 10993)、滅菌確效(如EN 556) 、熱原試驗(參照各國藥典)等。
< 回頂端 >
|





















